A. Benyamine (1,2) ; J. Magalon (2,3,4,5) ; F. Sabatier (2,3,4,5) ; L. Lyonnet (4) ;C. Dumoulin (3,4) ; S. Robert (2) ; G. Kaplanski (6) ; K. Mazodier (6) ; M. Reynaud-Gaubert (7) ; S. Morange (5) ; P. Rossi (1,2) ; F. Dignat-George (2,4) ; P. Paul (2,3,4,5) ; B. Granel (1,2)
(1) Médecine interne, Hôpital Nord, Marseille (2) Aix Marseille Univ, INSERM, INRA, C2VN, Marseille (3) Laboratoire de Thérapie Cellulaire, Hôpital de la Conception, Marseille (4) Laboratoire d’hématologie et biologie vasculaire, Hôpital de la Conception, Marseille (5) Centre d’investigation clinique (cic-bt 510), Hôpital de la Conception, Marseille (6) Service de médecine interne et immunologie clinique, Hôpital de la Conception, Marseille (7) Service de pneumologie, maladies respiratoires rares, mucoviscidose, Hôpital Nord, Marseille
Introduction : La fractalkine (CX3CL1) et les microparticules endothéliales (MPE) circulantes sont des marqueurs de l’activation inflammatoire endothéliale de la sclérodermie systémique (ScS). CX3CL1 est une molécule d’adhésion membranaire endothéliale induite et une chimiokine impliquée dans le recrutement, la transmigration et l’activation cytotoxique des cellules immunes exprimant CX3CR1, récepteur de CX3CL1. Notre but était d’explorer l’axe CX3CL1/CX3CR1 dans la ScS.
Matériel et Méthodes : Etude monocentrique (NCT 02636127) sur 15 patientes ScS (âge médian 55 ans, 11 formes cutanées limitées) et 15 témoins sains. Nous avons quantifié les cellules immunes cytotoxiques circulantes ainsi que l’expression de CX3CR1 et de CXCR4. Nous avons étudié le profil d’activation des cellules NK et leur potentiel à activer l’endothelium in vitro.
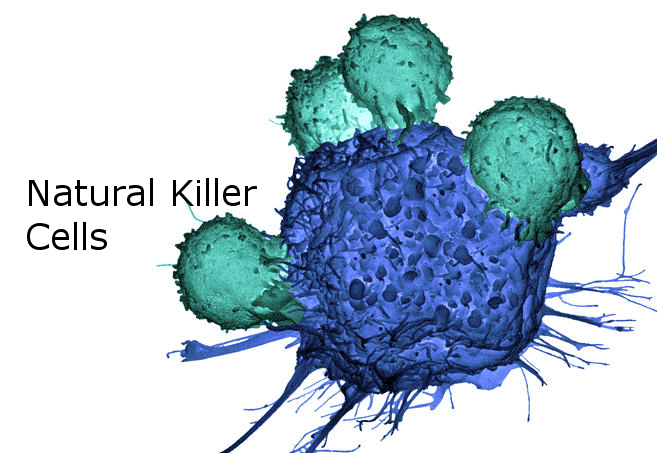
Résultats : Chez les patients ScS, le taux sérique de CX3CL1 était plus élevé. Le nombre de LTCD8 était diminué sans différence d’expression de CX3CR1. Le nombre de LTγδ et de cellules NK était préservé. Les pourcentages de cellules NK CX3CR1+, CXCR4+, NKG2D+, CD69+ étaient diminués. Le pourcentage de cellules NK CD16+ était conservé. La lignée HMVEC-d exposée aux cellules mononucléées du sang périphérique entraînait une dégranulation des cellules NK similaire chez les patients ScS et les témoins. Les cellules NK purifiées des patients ScS induisaient une libération accrue de MPE.
Discussion : Cette étude met en évidence un phénotype des cellules NK dans la ScS, caractérisé par une diminution de l’expression des récepteurs aux chimiokines et des récepteurs d’activation. L’expression diminuée du CX3CR1 pourrait suggérer son engagement avec son ligand endothélial CX3CL1 et le recrutement des cellules NK, à travers l’endothélium vers les organes cibles. Notre étude souligne également le rôle des cellules NK en tant qu’activateur endothélial par le biais d’une libération accrue des MPE.
Références
- Hasegawa M, Sato S, Echigo T, Hamaguchi Y, Yasui M, Takehara K. Up regulated expression of fractalkine/CX3CL1 and CX3CR1 in patients with systemic sclerosis. Ann Rheum Dis (2005) 64:21–28. doi:10.1136/ard.2003.018705
- Benyamine A, Magalon J, Cointe S, Lacroix R, Arnaud L, Bardin N, Rossi P, Francès Y, Bernard-Guervilly F, Kaplanski G, et al. Increased serum levels of fractalkine and mobilisation of CD34(+)CD45(-) endothelial progenitor cells in systemic sclerosis. Arthritis Res Ther (2017) 19:60. doi:10.1186/s13075-017-1271-7
- Nishimura M, Umehara H, Nakayama T, Yoneda O, Hieshima K, Kakizaki M, Dohmae N, Yoshie O, Imai T. Dual functions of fractalkine/CX3C ligand 1 in trafficking of perforin+/granzyme B+ cytotoxic effector lymphocytes that are defined by CX3CR1 expression. J Immunol (2002) 168:6173–6180.
- Benyamine A, Magalon J, Sabatier F, Lyonnet L, Robert S, Dumoulin C, Morange S, Mazodier K, Kaplanski G, Reynaud-Gaubert M, Rossi P, Dignat-George F, Granel B, Paul P. Natural Killer Cells Exhibit a Peculiar Phenotypic Profile in Systemic Sclerosis and Are Potent Inducers of Endothelial Microparticles Release. Front Immunol. (2018) 9:1665. doi: 10.3389/fimmu.2018.01665. eCollection 2018.





 Association des Sclérodermiques de France
Association des Sclérodermiques de France