Valentini G, Huscher D, Riccardi A, Fasano S, Irace R, Messiniti V, et al.
Khanna D, Spino C, Johnson S, Chung L, Whitfield M, Denton CP, et al. Abatacept in Early Diffuse Cutaneous Systemic Sclerosis – Results of a Phase 2 Investigator‐Initiated, Multicenter, Double‐Blind Randomized Placebo‐Controlled Trial.
Liens: Arthritis Rheumatol [Internet]. 24 juill 2019 [cité 23 sept 2019]; Disponible sur: https://onlinelibrary.wiley.com/doi/abs/10.1002/art.41055 (PubMed)
Résumé par le Docteur Alain LESCOAT (CHU Rennes)

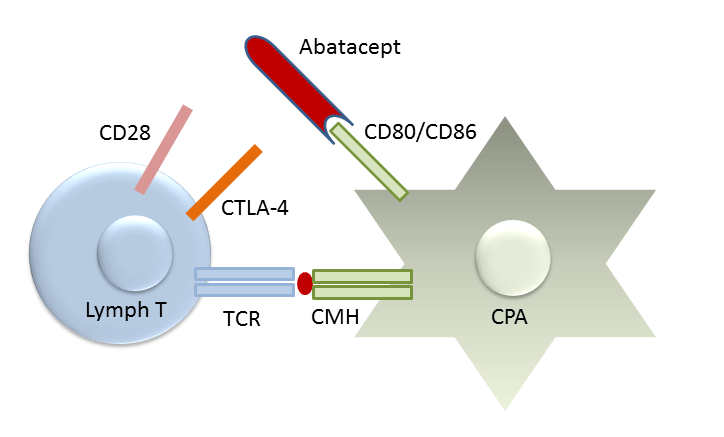
Introduction : L’Abatacept a démontré son efficacité sur l’atteinte cutanée et pulmonaire dans des modèles murins de sclérodermie systémique. Cette étude de phase 2 visait à évaluer l’efficacité et la tolérance de ce traitement sur la fibrose cutanée au cours de la sclérodermie systémique avec atteinte cutanée diffuse évoluant depuis moins de 3 ans.
Matériel et méthodes : Cet essai de phase 2, randomisé, contrôlé contre placebo en double aveugle, incluait deux bras sur une période de 12 mois : l’un recevant une injection hebdomadaire sous-cutanée d’abatacept (125mg SC/semaine), l’autre une injection hebdomadaire de placebo. Les patients présentant une forme diffuse de la maladie évoluant depuis moins de 3 ans et répondant aux critères ACR/EULAR 2013 de la maladie pouvaient être inclus. Les patients étaient stratifiés à l’inclusion selon la durée de la maladie (moins de 18 mois et entre 18 et 36 mois) du fait d’une évolution/sévérité de l’atteinte cutanée jugée différente entre ces deux strates. Une corticothérapie à moins de 10mg/jour ou la prise d’AINS était acceptée si les doses étaient stables depuis au moins 2 semaines. Les patients recevant d’autres immunomodulateurs ne pouvaient être inclus. L’introduction d’un immunosupresseur de sauvetage était autorisée après 6 mois d’essai en cas de dégradation de l’atteinte cutanée. Cet évènement était considéré comme un échec de traitement. Le critère d’étude principal était l’évolution de la fibrose cutanée évaluée par le score de Rodnan modifié (mRSS).
Résultats : 44 patients ont été inclus dans chaque bras. Cette étude était négative sur le critère d’étude principal : il n’était pas retrouvé de différence significative sur l’évolution de l’atteinte cutanée : mRSS évoluant de -6,24 (SE 1,14) dans le groupe traité contre -4,49 (1,14) dans le groupe placebo avec une différence non significative de -1,75 (IC95% (-4,93, 1,43) ; p=0,028) en faveur de l’abatacept. Certains critères secondaires semblaient montrer une différence entre les deux bras, notamment l’HAQ-DI (altération de +0,11 (0,07) dans le groupe placebo et amélioration de -0,17 (0,07) dans le groupe abatacept). 16% des patients dans le groupe abatacept avaient nécessité l’introduction d’un traitement immunosupresseur de sauvetage contre 36% dans le groupe placebo. La tolérance de l’abatacept était jugée bonne puisque les évènements indésirables (de tout type, infectieux ou sévères) étaient plus fréquents dans le groupe placebo.
Conclusion : Cette étude de phase 2 ne retrouve pas de bénéfice de l’abatacept sur l’évolution de la fibrose cutanée dans la forme diffuse précoce de la maladie. Certains critères secondaires semblaient montrer une différence en faveur de l’abatacept, notamment la qualité de vie (HAQ-DI) et la nécessité d’introduire un traitement immunosuppresseur de sauvetage. Une étude de phase 3 pourrait permettre de confirmer et préciser ces résultats.





 Association des Sclérodermiques de France
Association des Sclérodermiques de France