« Tocilizumab dans la sclérodermie systémique: un essai de phase 3 randomisé, en double aveugle, versus placebo »
Journal: Lancet Respiratory Medicine
Auteurs : Dinesh Khanna, Celia J F Lin, Daniel E Furst, Jonathan Goldin, Grace Kim, Masataka Kuwana, Yannick Allanore, Marco Matucci-Cerinic, Oliver Distler, Yoshihito Shima, Jacob M van Laar, Helen Spotswood, Bridget Wagner, Jeffrey Siegel, Angelika Jahreis, Christopher P Denton, focuSSced investigators
Lancet Respir Med. 2020 Oct; 8(10):963-974.
doi: 10.1016/S2213-2600(20)30318-0. PMID: 32866440
Résumé par Fanny Mariette et Benjamin Chaigne
Contexte :
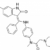
L’essai de phase 2 contrôlé randomisé faSScinate, a évalué l’efficacité et la tolérance du TOCILIZUMAB* dans la sclérodermie systémique. Le critère de jugement principal qui était la modification du score cutané modifié de Rodnan (mRSS) à 24 semaines n’a pas été atteint : -3,92 dans le groupe TOCILIZUMAB contre -1,22 groupe contrôle avec une différence de -2,70 [95%IC –5,85 – 0,45], p=0,09. Néanmoins, dans cet essai, moins de patients traités par TOLICIZUMAB ont eu une baisse de la capacité vitale forcée (CVF), probablement en lien avec la réduction de l’expression de gènes associés aux macrophages profibrotiques. L’article résumé ici présente l’essai de phase III foccussced qui fait suite à l’étude faSScinate.

* anticorps monoclonal humanisé inhibiteur du récepteur a de l’interleukine (IL)-6 qui se lie spécifiquement aux fractions soluble et membranaire du récepteur, bloquant la transmission du signal médié par ce récepteur.
Matériel et méthodes :
focussced est un essai de phase III multicentrique, randomisé, en double aveugle, contrôlé contre placebo, réalisé dans 75 sites dans 20 pays d’Europe, Amérique du Nord, Amérique Latine, et Japon. Les critères d’inclusion sont les adultes avec une sclérodermie systémique cutanée diffuse selon les critères ACR/EULAR 2013 depuis maximum 60 mois, avec un mRSS entre 10 et 35, un syndrome inflammatoire biologique (CRP > 6 mg/L ou VS > 28 mm/h ou plaquettes > 330 G/L), une maladie récente (<18 mois) ou active sur la peau et les articulations. L’atteinte pulmonaire n’était pas un critère d’inclusion et les patients avec une CVF < 55% ou une DLCO < 45% ont été exclus.
Le critère de jugement principal est le mRSS à 48 semaines.
Résultats :
Entre le 20/11/2015 et le 14/02/2017, 343 patients ont été éligibles dont 131 (38%) exclus. 212 patients ont été randomisés : 107 dans le groupe placebo et 105 dans le groupe TOCILIZUMAB. Les populations sont similaires dans les 2 groupes, les patients avaient une maladie récente évoluant en moyenne depuis moins de 2 ans dans les 2 groupes. Les mRSS initiaux et les CVF étaient comparables dans les 2 groupes (mRSS moyen à 20,4 (écart-type 7,0) dans le groupe placebo et 20,3 (6,7) dans le groupe TOCILIZUMAB ; et CVF moyenne à 83,9% (15,0) dans le groupe placebo et 80,3% (14,4) dans le groupe TOCILIZUMAB).

Le critère de jugement principal, qui est la modification du mRSS à 48 semaines n’est pas atteint : -4,4 (-6,0 à -2,9) dans le groupe TOCILIZUMAB contre -6,1 (-7,7 à -4,6) dans le groupe placebo (p=0,10).
On ne retrouve pas de différence concernant les questionnaires de qualité de vie et handicap entre les 2 groupes (HAQ-DI, patient global assessement VAS, physician global assessement VAS, FACIT-Fatigue, SHAQVAS, SRGQ). Cependant, la différence médiane de la baisse de la valeur de la CVF (critère de jugement secondaire) est en faveur du groupe TOCILIZUMAB : -0,6% [-2,4 à -0,9] dans le groupe placebo contre -3,9% [-4,8 à -1,6] dans le groupe TOCILIZUMAB avec une différence de 4,2 [2,0-6,4]. De plus, moins de patients ont eu une baisse de la CVF de plus de 10% dans le groupe TOCILIZUMAB comparé au groupe placebo : 5% des patients contre 17%. Concernant les effets indésirables, il n’y a pas de différence entre les groupes, avec un taux important de patient ayant au moins un effet indésirable (77% dans le groupe placebo et 86% dans le groupe TOCILIZUMAB).
Conclusion :
D’après cette étude, le TOCILIZUMAB n’a pas d’effet sur l’atteinte cutanée de la SSc évaluée par le score cutané modifié de Rodnan. Cependant, les résultats concernant l’atteinte pulmonaire évaluée par la CVF sont encourageants et méritent d’être confirmés dans un étude de phase III dédiée.





 Association des Sclérodermiques de France
Association des Sclérodermiques de France