Titre article original : Belimumab for the Treatment of Early Diffuse Systemic Sclerosis: Results of a Randomized, Double-Blind, Placebo-Controlled, Pilot Trial
Nom auteurs : Gordon JK, Martyanov V, Franks JM, Bernstein EJ, Szymonifka J, Magro C, et al.
rédacteur de la veille bibliographique: Dr Sébastien SANGES (Lille)
Lien: https://www.ncbi.nlm.nih.gov/pubmed/29073351
Revue: Arthritis Rheumatol Hoboken NJ. 2017 Oct 26; (PubMed)
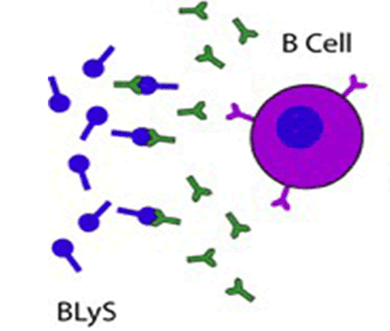 Plusieurs arguments cliniques et fondamentaux suggèrent l’implication du lymphocyte B (LB) dans la physiopathologie de la sclérodermie systémique (SSc). Notamment, les taux sériques de BAFF (B cell activating factor of the TNF family) sont élevés et corrélés au degré d’extension de la fibrose cutanée chez les patients sclérodermiques. Il existe donc un rationnel à l’utilisation du belimumab, anticorps monoclonal anti-BAFF, dans la SSc, dont l’efficacité et la tolérance étaient évaluées dans cette étude pilote américaine.
Plusieurs arguments cliniques et fondamentaux suggèrent l’implication du lymphocyte B (LB) dans la physiopathologie de la sclérodermie systémique (SSc). Notamment, les taux sériques de BAFF (B cell activating factor of the TNF family) sont élevés et corrélés au degré d’extension de la fibrose cutanée chez les patients sclérodermiques. Il existe donc un rationnel à l’utilisation du belimumab, anticorps monoclonal anti-BAFF, dans la SSc, dont l’efficacité et la tolérance étaient évaluées dans cette étude pilote américaine.
Il s’agit d’un essai thérapeutique monocentrique, mené en double aveugle, et randomisé contre placebo. Les critères d’inclusion étaient les suivants : diagnostic de SSc conforme aux critères ACR 1980 et ACR/EULAR 2013 ; forme cutanée diffuse selon les critères de Leroy et Medsger ; durée d’évolution < 3 ans à partir du 1er symptôme hors Raynaud ; score de Rodnan modifié (mRSS) ≥ 16 ; âge > 18 ans. Les critères d’exclusion étaient les suivants : DLCO < 30% de la valeur théorique ; FEVG < 50% ; traitement par mycophénolate mofetil (MMF) > 3 mois ; traitement préalable par rituximab ou belimumab ; traitement par prednisone > 10 mg/j.
Au total, 20 patients étaient inclus et recevaient des perfusions de belimumab 10 mg/kg (n=10) ou placebo (n=10) à J0, J15, J30 puis tous les mois pendant 52 semaines, en association avec un traitement de fond par MMF 2 g/j initié 3 mois avant la première perfusion.
Concernant l’efficacité, le critère de jugement principal était l’amélioration du mRSS (Tableau 1). Dans le groupe belimumab, le mRSS médian passait de 27 (écart interquartile 26,5;31) à 18 (11;23) (p=0.039). Dans le groupe placebo, le mRSS médian passait de 28 (22;28) à 21 (14;25) (p=0,023). Le mRSS diminuait donc d’une médiane de -10 (-13;-9) dans le groupe belimumab et de -3,0 (-15;-1) dans le groupe placebo (p=0,411). Dans le groupe belimumab, il y avait 7 patients répondeurs contre 3 dans le groupe placebo (p=0,153). Le critère de jugement principal n’était donc pas atteint. Parmi les critères de jugement secondaire, seuls le score sHAQ-DI et l’EVA Raynaud étaient significativement améliorés à 52 semaines dans le groupe belimumab (Tableau 1).
Concernant la tolérance, le nombre d’adverse events (AE) était comparable dans les 2 groupes (53 pour le belimumab et 56 pour le placebo, p=0,868), dont environ un tiers d’infection (18 pour le belimumab et 16 pour le placebo, p=0,818). Au total, 3 AE justifiaient une hospitalisation (crise d’angoisse, douleur thoracique et dyspnée), tous dans le groupe placebo.
Par ailleurs, les auteurs ont également identifié un certain nombre de gènes exprimés différentiellement dans la peau des patients répondeurs du groupe belimumab. Ceux-ci codent pour des protéines impliquées dans les voies de signalisation du LB et des processus fibrosants.
Les auteurs concluent que cette étude pilote démontre la sécurité du belimumab dans la SSc et sa possible efficacité (à la fois au plan clinique et fondamental), sous réserve d’un petit effectif.
Mots clés : belimumab





 Association des Sclérodermiques de France
Association des Sclérodermiques de France