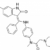
Veille biographique: Recherche physiopathologique
La signature de l’interféron de type I est présente dans la sclérose systémique avant la fibrose et pourrait contribuer à sa pathogénie travers une surexpression du gène de BAFF et la synthèse augmentée de collagène
D’après : The interferon type I signature is present in systemic sclerosis before overt fibrosis and might contribute to its pathogenesis through high BAFF gene expression and high collagen synthesis: Proposée par le Dr Laurence MICHEL, INSERM U976. Centre Universitaire de Recherche en Dermatologie.
Auteurs: Brkic Z, van Bon L, Cossu M, van Helden-Meeuwsen CG, Vonk MC, Knaapen H, van den Berg W, Dalm VA, Van Daele PL, Severino A, Maria NI, Guillen S, Dik WA, Beretta L, Versnel MA, Radstake T
Lien pubmed: http://www.ncbi.nlm.nih.gov.gate2.inist.fr/pubmed/26371289
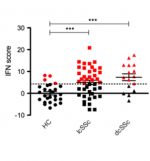
Distribution du score « Interféron de type I » (IFN score) chez les patients atteints d’une sclérodermie cutanée limitée (lcSSc) ou diffuse (dcSSc) versus des contrôles sains (HC). Les cas positifs sont en rouge.
Background :
Cet article étudie la « signature IFN de type I » caractéristique des maladies autoimmunes, dans les stades précoces de la sclérodermie systémique (SSc), avant qu’une fibrose cutanée ne se développe.
Méthodes :
L’expression de 11 gènes induits par l’IFN de type I a été testée dans le sang total provenant de 30 témoins sains sans aucun signe d’autoimmunité, chez 12 sujets ayant un phénomène de Raynaud primaire, 19 patients avec une SSc très précoce, 7 patients avec une SSc sans fibrose cutanée, 21 avec une SSc cutanée limitée et 10 sujets avec une SSc cutanée diffuse. De plus, une corrélation entre l’activité de l’IFN dans les monocytes, l’expression de l’ARNm de BAFF (B cell activating factor) et les taux sériques de la fraction N-terminale du propeptide du procollagène III (PIIINP) a été testée.
Résultats :
chez tous les patients SSc, quel que soit le groupe, une signature IFN de type I élevée est détectée, avant même que la fibrose n’apparaisse. Un « score IFN » calculé à partir des taux d’ARNm des gènes associés à l’IFN permet d’établir une prévalence de cette signature : Témoins=3.3%; Raynaud=33.3%, SSc très précoce=78.9%, SSc sans fibrose=100%, SSc cutanée limitée =42.9%, SSc cutanée diffuse =70.0%. Dans les monocytes, un score IFN ≥4.12 distingue les contrôles des patients atteints de SSc avec une fibrose. De plus, les monocytes des patients ayant une signature IFN expriment des taux d’ARNm de BAFF que les monocytes des patients sans signature IFN, ceci étant corrélé à des taux de PIIINP sériques significativement plus élevés.
Conclusion :
Une signature IFN de type I est détectable chez les patients atteints de SSs dès premières phases de la maladie, avant même l’apparition d’une fibrose cutanée, ce quisuggère une contribution de cette signature dans la pathogenèse et la progression de la SSC via une stimulation de l’autoimmunité et de la fibrose.





 Association des Sclérodermiques de France
Association des Sclérodermiques de France