Spiera R, Hummers L, Chung L, Frech TM, Domsic R, Hsu V, et al. Safety and efficacy of lenabasum in a phase 2 randomized, placebo‐controlled trial in adults with systemic sclerosis. Arthritis Rheumatol [Internet]. 26 avr 2020 [cité 25 mai 2020]; (PubMed)

Résumé par le Docteur Alain LESCOAT (CHU Rennes)
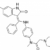
Introduction : Cette étude est un essai de phase 2 en double aveugle, randomisé contre placebo visant à évaluer l’efficacité et la sécurité d’utilisation du lenabasum au cours de la sclérodermie systémique (ScS) avec atteinte cutanée diffuse. Le rationnel est que le lenabasum est un agoniste du récepteur de type 2 aux cannabinoïdes, une voie participant à la résolution de l’inflammation médiée par la réponse immune innée et qui pourrait donc participer à améliorer l’évolution clinique au cours de la sclérodermie systémique.
Matériel et méthodes : Le critère d’étude utilisé pour évaluer l’efficacité du lenabasum oral dans cette étude est le CRISS, un critère composite permettant de déterminer la probabilité d’amélioration des patients, en se basant notamment sur l’évaluation combinée de la survenue d’une complication majeure imputée à la ScS (crise rénale, HTAP notamment) puis de l’évolution de l’atteinte pulmonaire via la CVF, de l’atteinte cutanée via le score de Rodnan (mRSS), de l’évaluation globale de l’état de santé jugée par le patient et le médecin par une échelle visuelle analogique, et de l’impact sur la qualité de vie via l’HAQ sur la période d’étude fixée initialement à 12 semaines et allant ici jusqu’à 16 semaines. Seuls les patients avec une forme cutanée diffuse étaient inclus, tous avaient une durée d’évolution de la maladie de moins de 6 ans, avec des marqueurs inflammatoires augmentés (CRP, IL-6), un score de Rodnan élevé et/ou évolutif. Les immunosuppresseurs à dose stable depuis plus de 3 mois (à l’exception du cyclophosphamide et du rituximab) étaient autorisés. Les patients très sévères, tels que les patients inscrits sur listes de greffes d’organe ou sous oxygénothérapie ne pouvaient être inclus. Des biopsies cutanées étaient également réalisées à visée d’études translationnelles.

Résultats : Les patients étaient randomisés et répartis en deux groupes (lenabasum vs placebo) avec un ratio de 2:1. Sur les 61 patients éligibles, 28 patients ont été inclus dans le groupe lenabasum dont 27 ayant finalement reçu le traitement et 15 dans le groupe placebo. La probabilité d’amélioration selon le CRISS était de 0,00 (Ecart inter quartiles : 0,00-0,16) dans le groupe placebo et de 0,33 (0,01-0,82) dans le
groupe lenabasum (p en analyse unilatérale = 0,04 ; bilatérale 0,07) à 16 semaines. Il existait une tendance à l’amélioration du mRSS à la 16ème semaine (différence entre les deux groupes 2,6 (+/-1,9) à la faveur du lenabasum (p en analyse unilatérale = 0,09 ; bilatérale 0,17). Les données histologiques cutanées sont en faveur d’une diminution des stigmates inflammatoires et de la fibrose dans le groupe lenabasum par rapport au placebo. Il n’y a pas eu d’évènement indésirable majeur imputable au traitement. Un patient a arrêté le lenabasum du fait de vertiges.
Conclusion : Cet essai de phase 2 apporte certains arguments en faveur d’un possible intérêt du lenabasum dans la forme cutanée diffuse précoce au cours de la sclérodermie systémique, à 16 semaines. Les données à 12 semaines lui sont moins favorables. Une étude de phase 3 est nécessaire pour confirmer ces premiers résultats, une attention particulière sur la durée de cette étude de phase 3 sera nécessaire pour juger de la pertinence clinique des résultats.

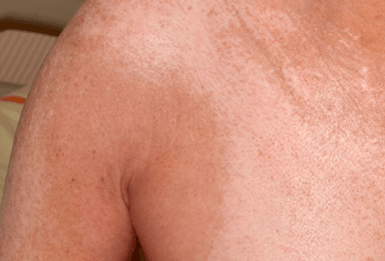


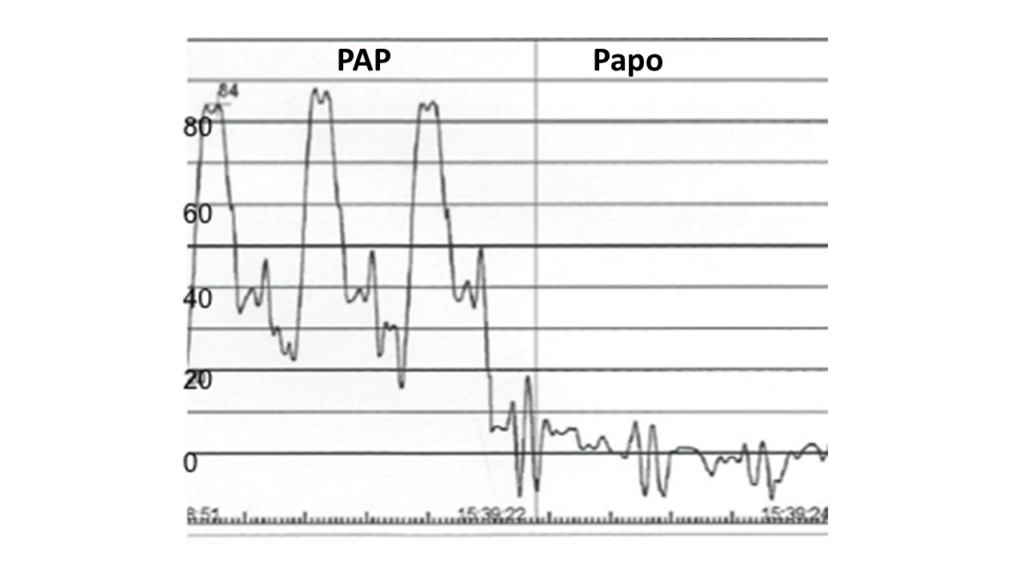
 Introduction : La sclérodermie systémique est une maladie hétérogène associée à une multitude de présentations cliniques différentes avec un pronostic très variable. Si la classification de la maladie a été mise à jour il y a peu (initiative ACR/EULAR 2013), la définition de sous-groupes homogènes de patients au sein de cette récente classification se base encore sur l’ancienne approche de LeRoy définie en 1988 et qui subdivise la maladie en deux grandes sous-entités, que sont l’atteinte cutanée limitée et l’atteinte cutanée diffuse, basées sur l’extension de la fibrose cutanée. Néanmoins, si cette vision dichotomique de la maladie semblait à l’époque pertinente en termes de survie, mettant en avant le pronostic sombre associé à la forme cutanée diffuse, des données récentes viennent la remettre en cause, en s’appuyant notamment sur l’existence de formes cutanées limitées avec atteintes viscérales sévères. Les auteurs de ce travail proposent donc de réaliser une étude phénotypique des patients sclérodermiques en utilisant une méthode de regroupement sans a priori sur une vaste population afin de mettre en évidence des nouveaux sous-groupes (ou clusters) homogènes de patients ne se basant pas sur l’extension de la fibrose cutanée mais intégrant à la fois des données cliniques, immunologiques et d’atteintes viscérales.
Introduction : La sclérodermie systémique est une maladie hétérogène associée à une multitude de présentations cliniques différentes avec un pronostic très variable. Si la classification de la maladie a été mise à jour il y a peu (initiative ACR/EULAR 2013), la définition de sous-groupes homogènes de patients au sein de cette récente classification se base encore sur l’ancienne approche de LeRoy définie en 1988 et qui subdivise la maladie en deux grandes sous-entités, que sont l’atteinte cutanée limitée et l’atteinte cutanée diffuse, basées sur l’extension de la fibrose cutanée. Néanmoins, si cette vision dichotomique de la maladie semblait à l’époque pertinente en termes de survie, mettant en avant le pronostic sombre associé à la forme cutanée diffuse, des données récentes viennent la remettre en cause, en s’appuyant notamment sur l’existence de formes cutanées limitées avec atteintes viscérales sévères. Les auteurs de ce travail proposent donc de réaliser une étude phénotypique des patients sclérodermiques en utilisant une méthode de regroupement sans a priori sur une vaste population afin de mettre en évidence des nouveaux sous-groupes (ou clusters) homogènes de patients ne se basant pas sur l’extension de la fibrose cutanée mais intégrant à la fois des données cliniques, immunologiques et d’atteintes viscérales. 
 Titre: Left Ventricular Diastolic Dysfunction Predicts Mortality in Patients With Systemic Sclerosis
Titre: Left Ventricular Diastolic Dysfunction Predicts Mortality in Patients With Systemic Sclerosis



 Association des Sclérodermiques de France
Association des Sclérodermiques de France