Par le Pr Christian AGARD, CHU Nantes
Le congrès de la Société Européenne de Rhumatologie (European League Against Rheumatisms, EULAR) a eu lieu cette année du 10 au 13 juin 2015 dans la ville de Rome, la prestigieuse capitale italienne. Comme d’habitude, le congrès était très riche et la sclérodermie systémique n’était pas en reste. Vous trouverez ci dessous le résumé des données communiquées à ce congrès sur notre pathologie vedette.
- Essais randomisés contre placebo
- Formes particulières de ScS
- Recherche fondamentales et molécules à tester
- Recommandations
Le tocilizumab dans les formes diffuses : des résultats encourageants mais non significatifs…
Le tocilizumab (anticorps monoclonal dirigé contre le récepteur de l’interleukine 6 (IL-6)) a été évalué à la dose de 162 mg en une injection sous cutanée par semaine chez 87 patients ayant une sclérodermie systémique (ScS) diffuse de diagnostic récent dans le cadre d’une étude randomisée contre placébo, l’étude FASSCINATE (Khanna D, et al).
A 24 puis à 48 semaines, l’amélioration du score de Rodnan modifié était plus importante dans le groupe traité par tocilizumab (-6,33 en moyenne) que dans le groupe placébo (-2,77) mais cette différence n’était pas statistiquement significative. Il n’y avait pas non plus de différence significative sur le score de handicap global HAQ et le score de fatigue FACIT. A 48 semaines, la détérioration de la capacité vitale forcée (CVF) était moindre dans le groupe tocilizumab. La tolérance du tocilizumab était jugée satisfaisante, mais on notait une infection pulmonaire fatale chez un patient. Une étude de phase III est en cours de mise en place.
Absence d’effet préventif du macitentan sur les ulcérations digitales ischémiques…
Deux essais randomisés contrôlés (DUAL-1, DUAL-2) ont testé le macitentan, nouvel inhibiteur de l’endothéline-1, pour prévenir les ulcérations digitales (UD) ischémiques de la ScS (Denton CP, et al.). Ces 2 études ont inclus plus de 500 patients au total. Aucun effet bénéfique du macitentan n’a pu être observé à 16 semaines, même chez les patients ayant de nombreuses UD à l’inclusion, ce qui a conduit à interrompre prématurément l’étude DUAL-2. Les auteurs émettent l’hypothèse que les UD sont bien mieux prises en charge (traitement local notamment) qu’il y a 10 ans (date des études avec le bosentan) et que le délai de 16 semaines est probablement trop court pour observer un effet.
Le sildénafil en traitement curatif des UD, une étude négative mais des tendances intéressantes…
L’étude multicentrique française SEDUCE a inclus 83 patients (192 UD) randomisés pour recevoir en aveugle du sildénafil 20mg 3x/j ou du placébo pendant 12 semaines (Hachulla E., et al.). Un tiers des patients était sous bosentan à titre préventif. L’objectif principal, qui était de démontrer un délai moyen plus court de cicatrisation des UD sous sildénafil, n’a pas été atteint. Néanmoins, à S12, le nombre moyen d’UD était moins important dans le groupe sildénafil (0,86) que dans le groupe placébo (1,51, p=0,01) et le taux de cicatrisation était meilleur. Les patients sous bosentan à l’inclusion semblaient davantage tirer de bénéfice du sildénafil. Dans cette étude, la cicatrisation des UD sous placébo a été jugée plus importante que prévue, possiblement grâce à de meilleurs soins locaux qu’autrefois.
Inhiber le LPA par la molécule SAR100842, étude de phase 2 chez 32 patients…
Des données expérimentales ont décrit le rôle de l’acide lysophosphatidique (LPA) dans la pathogénie de la ScS. La molécule SAR100842, inhibiteur oral du récepteur du LPA, a été évaluée dans la ScS diffuse récente (inf36 mois) dans le cadre d’un essai de phase 2a de 8 semaines (Allanore Y, et al.). Cette étude randomisée contre placébo a inclus 32 patients. Le critère de jugement principal était la tolérance, qui était satisfaisante. A S8, l’amélioration du score de Rodnan était plus importante sous SAR100842 (-4) que sous placébo (-1). Un essai de plus grande envergure est envisagé avec cette molécule.
HTAP : les résultats d’AMBITION s’appliquent au sous-groupe « HTAP des connectivites »…
L’étude AMBITION a comparé 2 stratégies thérapeutiques de l’HTAP : monothérapie par Tadalafil ou Ambrisentan versus traitement combiné d’emblée par Tadalafil+Ambrisentan chez des patients naïfs de tout traitement spécifique de l’HTAP. Sur les 500 patients inclus dans cette étude, 187 ont une HTAP associée à une connectivite (dont 118 cas de ScS), et c’est l’analyse de ce sous-groupe qui a été présentée (Coghlan JG, et al.). Les résultats à S24 sont en faveur du traitement combiné d’emblée. Le délai d’aggravation clinique était retardé de 57% dans le groupe «traitement combiné» par rapport au groupe « monothérapie ». L’évolution du taux de NT-proBNP et celle du test de marche de 6 minutes (T6M) étaient également meilleures dans le groupe recevant la bi-thérapie. Les effets secondaires (œdèmes périphériques) y sont par contre un peu plus fréquents.
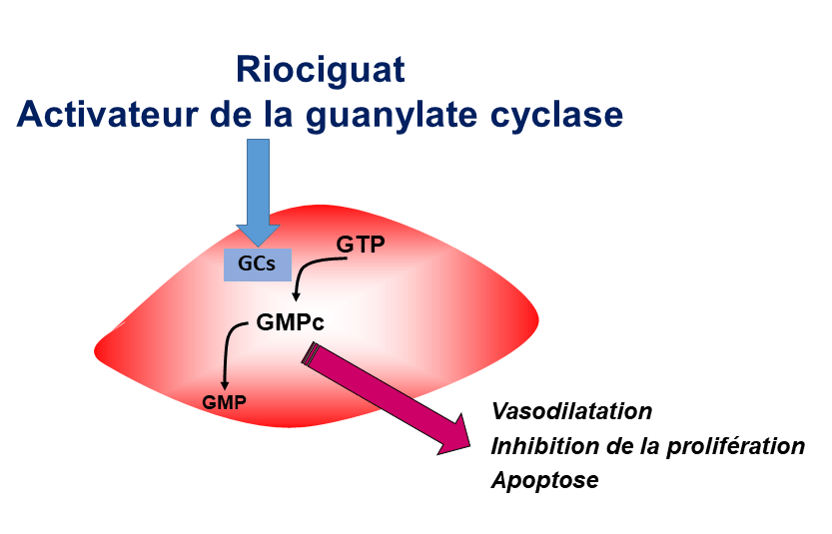
Données d’efficacité et de tolérance du riociguat dans l’HTAP des connectivites…
L’analyse des données d’efficacité et de tolérance du Riociguat dans le sous-groupe « HTAP des connectivites » (n=111, dont 66 ScS) des études PATENT-1 et 2 ont été présentées (Denton C, et al.). 71 patients ont été randomisés pour recevoir riociguat 2,5 mg x 3/j, 15 pour recevoir 1,5 mg x 3/j, et 25 pour recevoir le placébo. A S12, la distance moyenne parcourue au T6M était améliorée de 28 mètres sous riociguat 2,5mg, alors qu’elle diminuait de 8 mètres dans le groupe placébo. Cette amélioration était inférieure à celle observée pour l’ensemble des patients de PATENT-1 (+36m). La survie à 2 ans était de 95%. La tolérance était similaire à celle notée pour l’ensemble des patients de l’étude.
Suivant: Formes particulières de ScS







 Association des Sclérodermiques de France
Association des Sclérodermiques de France