Titre article original :Safety and efficacy of subcutaneous tocilizumab in systemic sclerosis : results from the open-label period of a phase II randomised controlled trial (faSScinate)
Nom auteurs : Dinesh Khanna, Christopher P Denton, Celia JF Lin, Jacob M van Laar, Tracy M Frech, Marina E Anderson, Murray Baron, Lorinda Chung, Gerhard Fierlbeck, Santhanam Lakshminarayanan, Yannick Allanore, Janet E Pope, Gabriela Riemekasten, Virginia Steen, Ulf Müller-Ladner, Helen Spotswood, Laura Burke, Jeffrey Siegel, Angelika Jahreis, Daniel E Furst..
rédacteur de la veille bibliographique: Dr Benjamin Chaigne, Pr Luc Mouthon
Lien: https://www-ncbi-nlm-nih-gov.gate2.inist.fr/pubmed/29066464
Revue: Annals of the Rheumatic Diseases
Contexte:: Le tocilizumab est un anticorps monoclonal ciblant la chaine α du récepteur de l’interleukine-6. L’essai de phase II faSScinate a été réalisé pour évaluer l’efficacité et la tolérance de ce biomédicament chez des patients atteints de sclérodermie systémique (ScS). Bien que le critère de jugement principal n’ait pas été atteint à l’issue de l’étude (48 semaines), une diminution du score cutané modifié de Rodnan (mRSS) avait été constatée. Cet article rapporte la prolongation de l’étude faSScinate dans un essai ouvert de 48 semaines supplémentaires.
Méthodes:: L’essai faSScinate était une étude contrôlée, prospective, randomisée, internationale, multicentrique évaluant la dose de 162mg sous–cutané hebdomadaire de tocilizumab vs placebo. Dans cette étude ouverte, sans groupe contrôle, tous les patients ayant participé à faSScinate avaient l’opportunité de recevoir pour 48 semaines le traitement.
Les critères d’inclusion étaient ceux de l’étude faSScinate.
Les critères de jugements étaient évalués à 96 semaines et comprenaient les proportions de patients avec une amélioration du mRSS de 20, 40 ou 60%, les proportions de patients ayant une amélioration clinique significative de leur mRSS (supérieure ou égale à 4.7), le score mRSSS, les pourcentage de capacité vitale forcée (CVF) et de la diffusion libre du monoxyde de carbone (DLCO) corrigée pour l’hémoglobine, les échelles d’évaluation VAS, HAQ-DI, FACIT, Pruritus 5-D et enfin le taux d’effets secondaires sévères ou non exprimés en nombre d’événements pour 100 patients-année.
Résultats
Des 87 patients inclus dans faSScinate (44 patients recevant le placebo, et 43 recevant le tocilizumab), 31 patients ayant reçu le placebo et 30 patients ayant reçu le biomédicament ont participé à l’étude ouverte et ont reçu le biomédicament pour 48 semaines. Au total, 24 patients ayant initialement reçu le placebo et 27 patients ayant uniquement le tocilizumab ont poursuivi l’étude jusqu’au terme des 96 semaines. L’ensemble des patients avait des caractéristiques cliniques et biologiques similaires au début de l’étude.
A l’issue de faSSCinate, la diminution moyenne (écart-type (intervalle de confiance à 95% 95%CC)) du score mRSS était de 3,1 (6,3 (0,9-5,4)) pour les patients recevant le placebo et de 5.6 (9,1 (2,4-8,9)) pour les patients ayant reçu le biomédicament, sans différence significative.
A 96 semaines, les patients ayant reçu le placebo puis le tocilizumab avaient une diminution totale de 9,4 (5,6 (2,4-8.9)) du mRSS et ceux ayant reçu uniquement le biomédicament avaient une diminution de 9,1 (8,7 (5,6-12,5)).
Parmi les patients ayant poursuivi l’étude jusqu’à 96 semaines, 10/24 (42% (95% IC 22% – 63%)) des patients ayant reçu le placebo puis le tocilizumab et 12/26 (46% (95% IC 27% – 67%)) des patients n’ayant reçu que le tocilizumab, ont eu une diminution de leur CVF; aucun patient n’a eu une diminution de plus 10% de CVF.
Le taux d’infection sévère en nombre/100 patients-année était de (95% IC) 10,9 (3,0-27,9) dans le groupe placebo et de 34,8 (18,0-60,8) dans le groupe tocilizumab à la fin de faSScinate puis de 19,6 (7,2-42,7) dans le groupe ayant initialement reçu le placebo puis le tocilizumab et de 0,0 (0,0-12,2) dans le groupe de patients n’ayant reçu que le tocilizumab.
Limites :
Cette étude comporte d’importantes limites. La principale est que tous les patients ont reçu le biomédicament pendant la phase de prolongation. On constate un taux important d’interruption de traitement et de sortie d’étude. Il n’y a donc pas de groupe contrôle et il n’est pas approprié de comparer les deux groupes
Conclusion :
Les auteurs de ce travail concluent que dans l’ensemble, les résultats de faSScinate et de cet essai ouvert de prolongation, suggèrent que le tocilizumab est associé à un bénéfice cutané et pulmonaire pour les patients atteints de ScS mais que ce traitement augmente le risque d’infection sévère. Ainsi, le tocilizumab pourrait être un traitement de patients avec une ScS aggravative pour lesquels il n’y a que peu d’option thérapeutique.
Perspectives :
Un essai de phase III évaluant le tocilizumab dans la ScS est actuellement en cours.
Références
PMID: 29066464
Mots clés : tocilizumab;faSScinate

 number 1S 2018 pp.1-284.
number 1S 2018 pp.1-284.

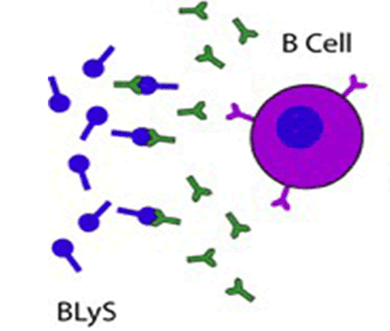 Plusieurs arguments cliniques et fondamentaux suggèrent l’implication du lymphocyte B (LB) dans la physiopathologie de la sclérodermie systémique (SSc). Notamment, les taux sériques de BAFF (B cell activating factor of the TNF family) sont élevés et corrélés au degré d’extension de la fibrose cutanée chez les patients sclérodermiques. Il existe donc un rationnel à l’utilisation du belimumab, anticorps monoclonal anti-BAFF, dans la SSc, dont l’efficacité et la tolérance étaient évaluées dans cette étude pilote américaine.
Plusieurs arguments cliniques et fondamentaux suggèrent l’implication du lymphocyte B (LB) dans la physiopathologie de la sclérodermie systémique (SSc). Notamment, les taux sériques de BAFF (B cell activating factor of the TNF family) sont élevés et corrélés au degré d’extension de la fibrose cutanée chez les patients sclérodermiques. Il existe donc un rationnel à l’utilisation du belimumab, anticorps monoclonal anti-BAFF, dans la SSc, dont l’efficacité et la tolérance étaient évaluées dans cette étude pilote américaine. in systemic sclerosis: A systematic
in systemic sclerosis: A systematic



 Association des Sclérodermiques de France
Association des Sclérodermiques de France