Titre original: Inhibition of angiogenesis by platelets in systemic sclerosis patients.
- Auteurs:Daniela Hirigoyen1, Paula I. Burgos1, Veronica Mezzano1, Josefina Duran1, Magaly Barrientos1, Claudia G. Saez, Olga Panes, Diego Mezzano and Mirentxu Iruretagoyena
- Lien Arthritis Research & Therapy (2015) 17:332
- Rédacteur du résumé: Pr Brigitte Granel, Marseille
Background :
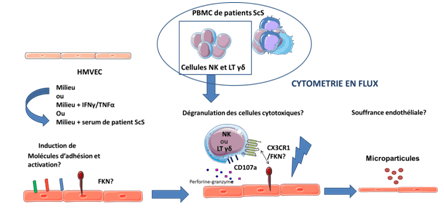
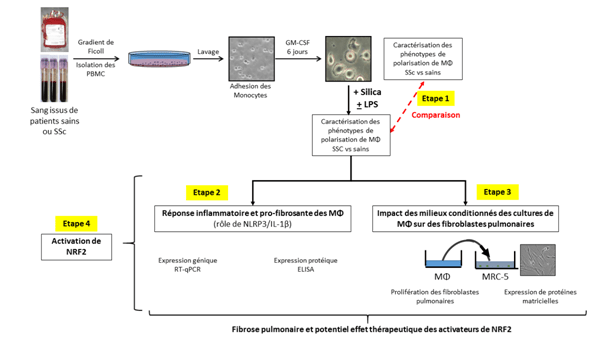
Les principales lésions observées au cours de la Sclérodermie systémique (ScS) incluent la microvasculopathie, la fibrose périvasculaire et interstitielle, l’altération de l’angiogénèse et l’autoimmunité. Principal acteur cellulaire impliqué dans l’hémostase et la thrombose, les plaquettes ont aussi un rôle important dans le maintien de l’intégrité vasculaire, l’angiogénèse, l’inflammation et la fibrose. Le but l’article est de comprendre la contribution des facteurs dérivés des plaquettes chez les patients atteints de ScS en analysant leurs effets sur l’angiogénèse (formation de tubules par les cellules endothéliales microvasculaires humaines dermiques – DMVEC), la sécrétion de cytokines profibrosantes et pro inflammatoires et la prolifération des fibroblastes. Les auteurs souhaitent ainsi mieux comprendre l’implication des plaquettes dans la pathologie de la ScS.
Méthodes :
Les plaquettes de 30 patients ayant une ScS (âge moyen 51,3 ans), et de 12 sujets sains (41,9 ans) étaient étudiées. L’angiogénèse était évaluée par la formation de tubules par les DMVEC sur Matrigel et les facteurs dérivés des plaquettes comme l’isoforme anti-angiogénique du vascular endothelial growth factor (VEGF165b). Le taux de CD40L, la sécrétion de cytokines inflammatoire et de sérotonine intraplaquettaire étaient analysés. L’effet du surnageant plaquettaire sur la prolifération des fibroblastes et l’expression de l’α-SMA étaient étudiés.
Résultats :
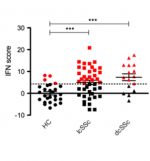
Le surnageant des plaquettes de patients souffrant de ScS a un effet inhibiteur sur la formation de microtubules des DMVEC en culture Matrigel (p < 0,01). Après mise en culture (6h) avec le surnageant des plaquettes de patients ScS, un taux élevé d’endothéline-1 (ARNm) dans les DMVEC était observé, en comparaison aux sujets témoins (p < 0,05). Chez les témoins, le taux d’endothéline 1 était significativement diminué, en comparaison avec les DMVEC non stimulées (état basal). La sécrétion de l’isoforme VEGF165b était significativement plus haute (p < 0,05) dans le surnageant des plaquettes de patients ScS que des témoins, et le ratio VEGF165b/VEGF était augmenté en comparaison aux sujets sains (tendance statistique, n = 12; p = 0,071). Une sécrétion élevée du transforming growth factor β (p < 0,01) et du CD40L (p < 0,01) était observée par les plaquettes des patients souffrant de ScS. Le taux de sérotonine intraplaquettaire était plus bas chez les patients ayant une forme cutanée diffuse SSc comparé à ceux avec une forme limitée et chez les témoins (p < 0,05).
Un effet prolifératif et une surexpression de l’α-SMA sur les fibroblastes en culture était observé, en comparaison à l’effet obtenu chez les sujets témoins.
Conclusion :
De par les résultats observés (effet antiangiogénique, sécrétion de VEGF165b, effet proinflammatoire et profibrosant), cette étude suggère que les plaquettes pourraient être associées aux lésions microvasculaires, au défaut de la réparation vasculaire et à la fibrose chez les patients souffrant de ScS.
Auteur du Résumé: Pr Brigitte Granel:
Service de médecine interne
CHU de Marseille – Hôpital Nord
FRANCE
Lien pubmed: http://www.ncbi.nlm.nih.gov/pubmed/26584613





 Association des Sclérodermiques de France
Association des Sclérodermiques de France